- 2
- 국내산라이츄
- 조회 수 5543

네 여러분 ㅇㅅㅇ/
오랜만에 강좌 올리네요.
요즘 직장에서 너무 체력적으로나 정신력도 그렇고 소모가 엄청 심해서 집에 오면 뭘 할 엄두가 안 납니다...OTL
1. 완충 용액이란 무엇인가
완충 용액의 사전적 정의는 '산이나 염기를 가해도 수소 이온 농도(pH)가 변하지 않게 하는 용액'입니다. 생물학쪽에서는 외부의 pH에 세포나 생분자(단백질같은 거)가 영향을 받지 않게 하는 용액을 말하고요. 영어로는 버퍼(buffer)라고 하는데 구글링하면 컴퓨터 버퍼 나오니까 buffer solution으로 찾아보세요. 그걸 왜 찾...
이거 참고로 여러분 체내에서도 돌아가는거예요. 여러분 이거 없으면 사이다 한잔 마시고 골로 가요.
2. 완충 용액이 돌아가는 원리
이 용액은 대체 뭔데 강산이 들어와도 강염기가 들어와도 탱킹을 하는걸까요? 기본적으로 완충 용액은 약산과 그 짝염기, 혹은 약염기와 그 짝산으로 만듭니다. 트리스 1M이 pH 10인데 약염기라뇨 보통 예로 많이 드는 건 아세트산과 아세트산 나트륨이니 그걸로 설명을 해 봅시다... 3_3
아세트산과 아세트산 나트륨 모두 물에 녹으면 분자가 찢어집니다.
CH3COOH <-> CH3COO + H
CH3COONa <-> CH3COO + Na
이 떄 왼쪽의 CH3COO가 아세트산 이온입니다. 그럼 이제 위에서 녹인 아세트산과 아세트산 나트륨 수용액을 섞어보겠습니다. 어? 수용액에 아세트산 이온의 농도가 높아졌네요? 그렇다면 평형을 유지하기 위해 아세트산과 아세트산 나트륨으로 파이널 퓨전!!! 하는 겁니다. 이게 르 샤틀리에의 원리에 의해 역반응이 일어나고 정반응이 일어나고... 그런 겁니다.
2-1) 르 사틀리에의 원리
르 샤틀리에의 원리는 '화학 평형 상태의 물질의 외부 조건(농도, 부피, 압력 등)을 변화시켰을 때, 화학 평형은 이 변화를 상쇄시키는 쪽으로 진행된다'는 겁니다. 예를 들어 설탕이 포도당과 과당으로 나눠지는 반응을 생각해봅시다.
Sucrose <-> Glucose+fructose
여기서 포도당과 과당을 추가로 더 넣으면 설탕이 포도당과 과당으로 분리되는 게 아니라, 평형을 유지하기 위해 포도당과 과당이 설탕이 됩니다. 그리고 설탕이 추가로 더 들어가게 되면 더 많은 설탕이 포도당과 과당으로 분리되는겁니다.
'ㅅ' 그럼 다시 완충용액이 돌아가는 원리로 돌아와서... 위의 아세트산+아세트산 나트륨 혼합물에 염산이 들어왔어요! 염산은 들어오자마자 H와 Cl로 찢어지게 되고, 수소 이온은 아세트산 이온과 결합해 아세트산이 됩니다. 수산화나트륨이 들어가게 되면 수산화기(OH)가 수소 이온과 합쳐져서 물이 되는거죠. 이런 원리로 완충 용액은 pH를 유지하는 겁니다. 잠깐 그럼 나머지 애들은 뭐해요?
3. 완충 용량과 범위
콤퓨타 외장하드도 용량이 정해져 있듯, 완충 용액도 그렇습니다. 어느 정도 완충 작용을 하다가 이온이 다 소진되면 더 이상 완충 용액으로서의 기능을 못 하게 돼요. 이것도 완충 용액 바이 완충 용액이고, 완충 용액의 경우 적정 pH의 범위까지 지정되어 있습니다. 대부분 pH는 6~8 이내에서 범위가 지정되어 있고(생체 pH 조건이 중성이라 그렇습니다) pH 3이나 9 부근같이 특수한 애들도 있긴 있습니다. ...아니 잠깐만 pH 10까지 본 거 같은데...
참고로 판매중인 완충 용액은 대부분 pH도 맞춰서 판매됩니다. 트리스같은 경우 Tris-HCl(얘는 Tris-base라는 형태로 된 걸 물에 녹인 다음 염산으로 pH를 맞춰줘야 완충 용액으로 기능합니다)로 pH 8.0부터 6.8까지 0.2단위로 맞춰서 팝니다. 염산이나 수산화나트륨으로 맞추기도 하지만 특수한 경우(염산이나 수산화나트륨 들어가면 망하는 경우)에는 다른 산이나 염기를 쓰기도 합니다.
단백질을 전기영동 할 때 쓰는 Tris-glycine buffer의 경우 염산으로 pH를 맞추면 전기영동 시스템에 이상이 생겨서 전기영동이 제대로 되지 않기 때문에 글라이신으로 맞추고, TBE buffer나 TAE buffer는 레시피에 따라 다르지만 일단 붕산과 아세트산이 pH를 맞춰줍니다. (대개 8.0 언저리입니다) 레시피에 따라 다르다고 한 이유는 이게 염산으로 pH를 맞추면 전기영동 중에 열이 난다는 얘기가 있어서요;;
4. 완충 용액의 사용처
일단 생물학쪽 실험은 이거 없으면 안 돌아갑니다. 심지어 동물세포를 배양하는 배지에도 들어가는데, 일반적으로 HEPES가 들어간 배지를 쓰거나 Bicarbonate buffer system(밑에 서술할 탄산 시스템)을 쓰는데 후자의 경우 이산화탄소가 5% 주입되는 환경에서 키워야 시스템이 제대로 작동하게 되고요.
DNA나 RNA를 전기영동 할 때도 쓰입니다. DNA도 pH에 따라 변성되거든요. 그리고 DNA나 RNA를 전기영동할 때 쓰는 완충 용액에는 공통적으로 EDTA가 들어가게 되는데, EDTA는 킬레이터로 2가 양이온을 붙잡아 DNA나 RNA를 분해하는 효소가 이걸 못 쓰게 만듭니다. DNA나 RNA를 분해하는 효소는 작동하기 위해 2가 양이온, 칼슘이나 마그네슘이 필요하거든요. 이거 안 넣으면? 전기영동을 했는데 DNA가 다 뽀사져따 예이!!! 가 됩니다... 아니 실화예요. 물론 단백질 전기영동 할 때도 쓰는데, 그건 얘랑 조성이나 pH가 달라요.
그 외에도 삼투압에 의한 변형을 방지하기 위해 체내와 염 농도까지 비슷하게 맞춘 완충 용액인 TBS와 PBS가 있습니다. 뒤의 BS는 buffered saline, 그러니까 완충용액+소금물이라는 의미이고 T는 트리스, P는 인산이고요. 둘이 비슷한 용도긴 한데 써도 되는 상황이랑 쓰면 안 되는 상황이 있긴 합니다.
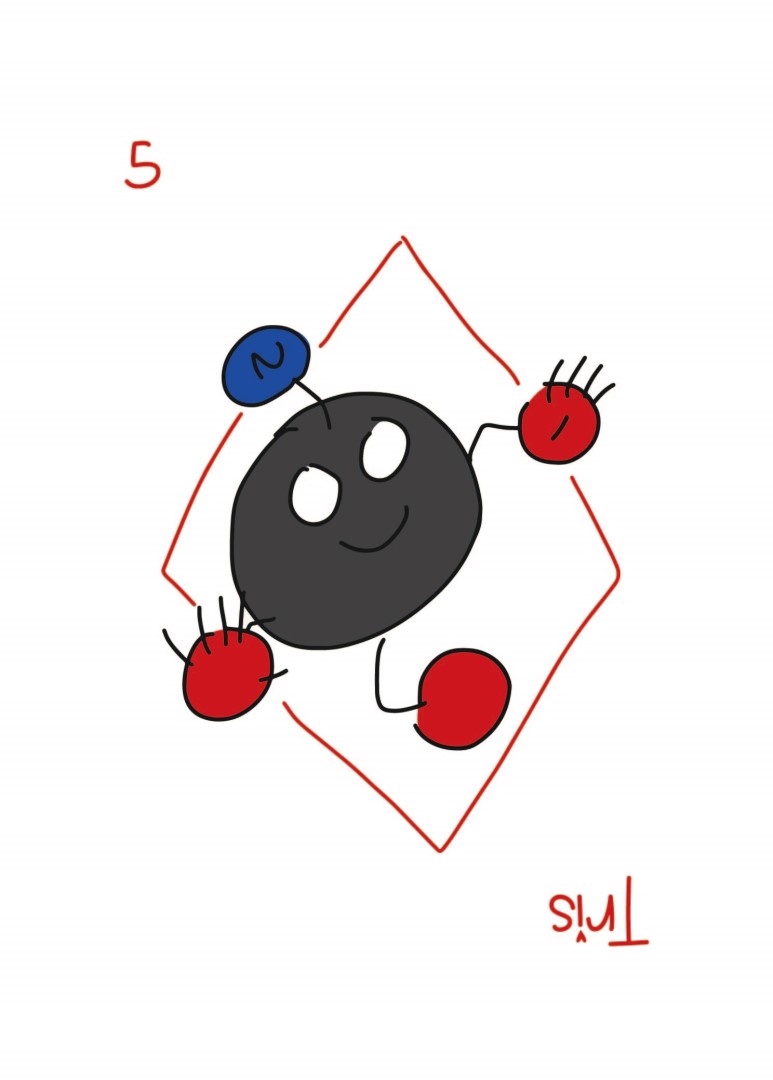
트리스는 이렇게 생겼는데(본인 그림임) 마빡에 저게 아민입니다. 아민은 작용기 이름이고, 저게 질소를 기준으로 탄소가 주변에 1, 2, 3개가 있으면 순서대로 1차, 2차, 3차 아민인데 트리스 마빡에 저건 1차 아민이고요. 저 1차 아민이 문제가 되는 경우 PBS를 사용하고(예: 1차 아민이 실험에 쓰이는 화합물과 반응하는 경우), 반대로 인산의 경우 2가 양이온을 만나면 침전이 생기는데다가 western blot을 할 때 Alkaline phosphatase를 사용할 때는 인산기가 방해를 하기 때문에 TBS를 씁니다. HRP를 쓰는 경우에는 상관 없는데 보통 웨스턴 할 땐 TBS 씁니다.
기본적으로 완충 용액을 만들 때 쓰이는 화합물들은 반응에 참여하면 안 됩니다. pH를 유지해 주는 역할 외에 반응에는 참여하면 안되기때문에 얘네가 시약이랑 반응하게 되면 사용하면 안 됩니다.

얘도 완충 용액입니다. Amine conjugation할 때말곤 못봤는데, pH가 4.6으로 맞춰져 있는 분말을 팔더라고요. 단백질이나 아미노산의 경우 등전점(전기적으로 중성인 상태의 pH)가 정해져 있고 그 pH 아래냐 위냐에 따라 전하가 정해지는데, 아마 접합하는 데 쓰는 단백질의 전하때문에 저걸 썼던 거 같습니다.
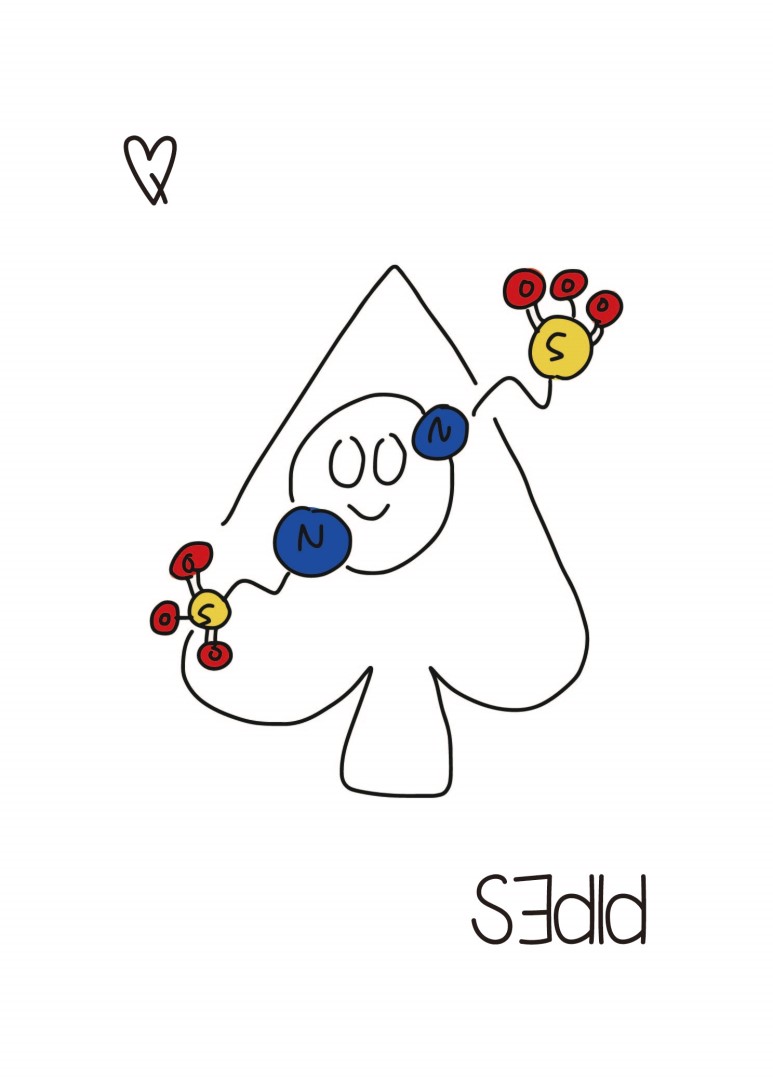
이놈도 완충 용액입니다. ...뭐 하는데 쓰세요?
5. 우리 몸 속에도 완충 용액이 있다고요?
아니 이거 없으면 여러분 음식먹다 죽어요... 진짜 떡볶이 먹다 골로 가요...
우리 몸의 효소를 포함한 단백질은 분해 효소(리소좀 내부의 그거)를 제외하면 대부분 pH가 중성일 때 정상적으로 작동하고 산성이나 염기성이 되면 변성됩니다. 그래서 이게 없으면 골로 가는거예요. 하지만 우리 몸은 피가 완충 용액이라 어느 정도는 괜찮습니다. 물론 용량 넘어가면 피가 산성이 되는 경우도 있지만 건강한 사람들은 괜찮아요.
우리 몸에서는 주로 탄산 이온 완충 용액 시스템(Bicarbonate buffer system)이 작동하지만, 인산도 어느정도 기여를 합니다. 인산이요? 아니 우리 몸에 인 생각보다 많아요 여러분 당황 댓츠노노 ㅇㅅㅇ
Bicarbonate buffer system, 즉 탄산 이온 완충 용액 시스템은 다음과 같은 원리로 체내의 pH를 유지하고 있습니다.
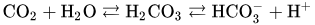
여러분 저 이산화탄소 호흡으로 나가는 그거 맞아요. 이산화탄소는 저렇게 탄산 형태로 녹여서 수송해요.
다음편은 메탄올과 에탄올입니다. ㅇㅅㅇ
 포함 1명이 추천
포함 1명이 추천






